在过去的2023年,华海药业国内外均收获颇丰:15个新品获批生产,总过评品种数扩容至54个;在美拿下9个ANDA文号,总获批ANDA号达90余个。2023前三季度华海药业研发费用6.67亿元,目前公司主要有16款创新药(13款1类新药)在研,2个单抗上市可期,此外51个新分类申报品种在审。
拿下15个新品!4大“光脚”品种备战第十批集采
2023年12月21日,国家药监局官网显示,华海药业申报的4类仿制药拉考沙胺片获批生产并视同过评。今年以来,公司已有15个品种首次获批生产并视同过评,涵盖神经系统、心脑血管系统、全身用抗感染等治疗领域。
2023年华海药业获批上市的仿制药
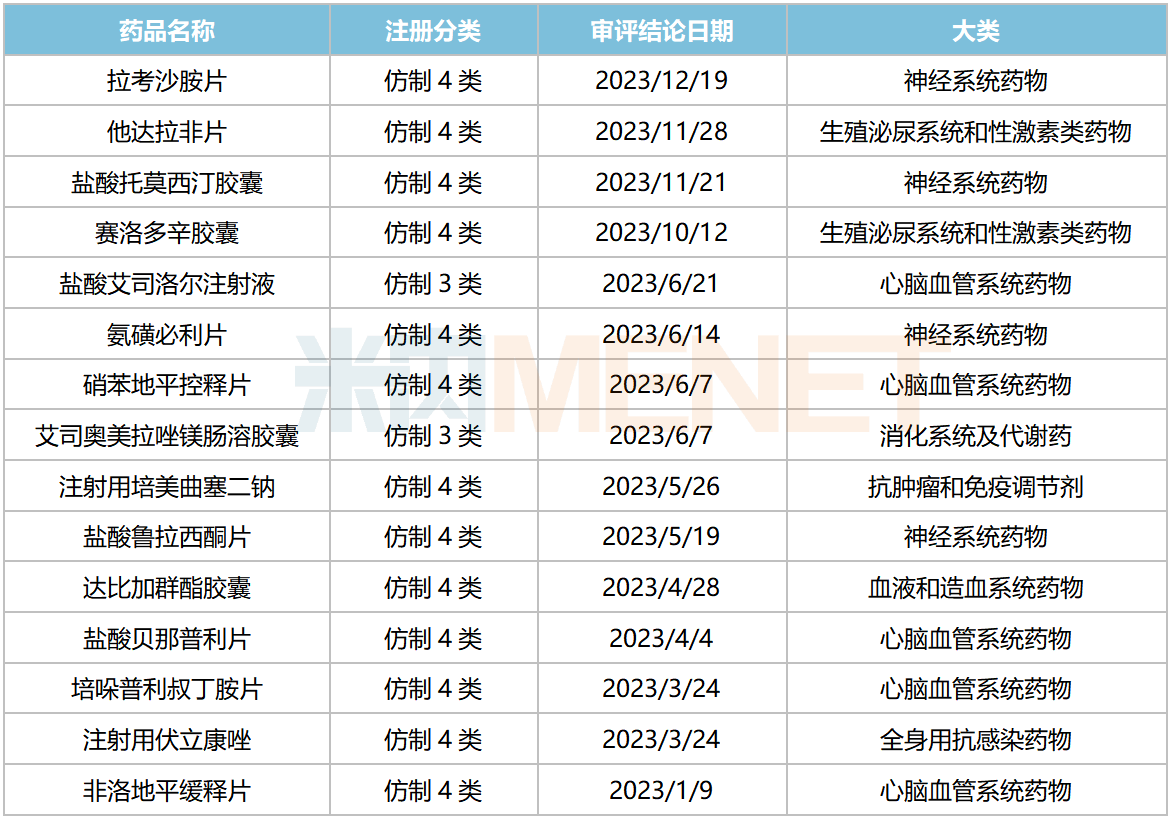
来源:米内网中国申报进度(MED)数据库
从市场规模看,15个品种2022年在中国三大终端六大市场(统计范围详见本文末)的销售额合计超过220亿元,包括他达拉非片(20亿+)、硝苯地平控释片(75亿+)、注射用培美曲塞二钠(32亿+)、注射用伏立康唑(24亿+)、非洛地平缓释片(33亿+)等大品种。
截至目前,华海药业已有54个品种过评/视同过评,其中15个品种为首家过评,赖诺普利片、福辛普利钠片、奈韦拉平片等为独家过评。从治疗领域看,54个品种涉及8大治疗领域,集中在神经系统药物(21个)、心脑血管系统药物(16个)等。
华海药业过评情况
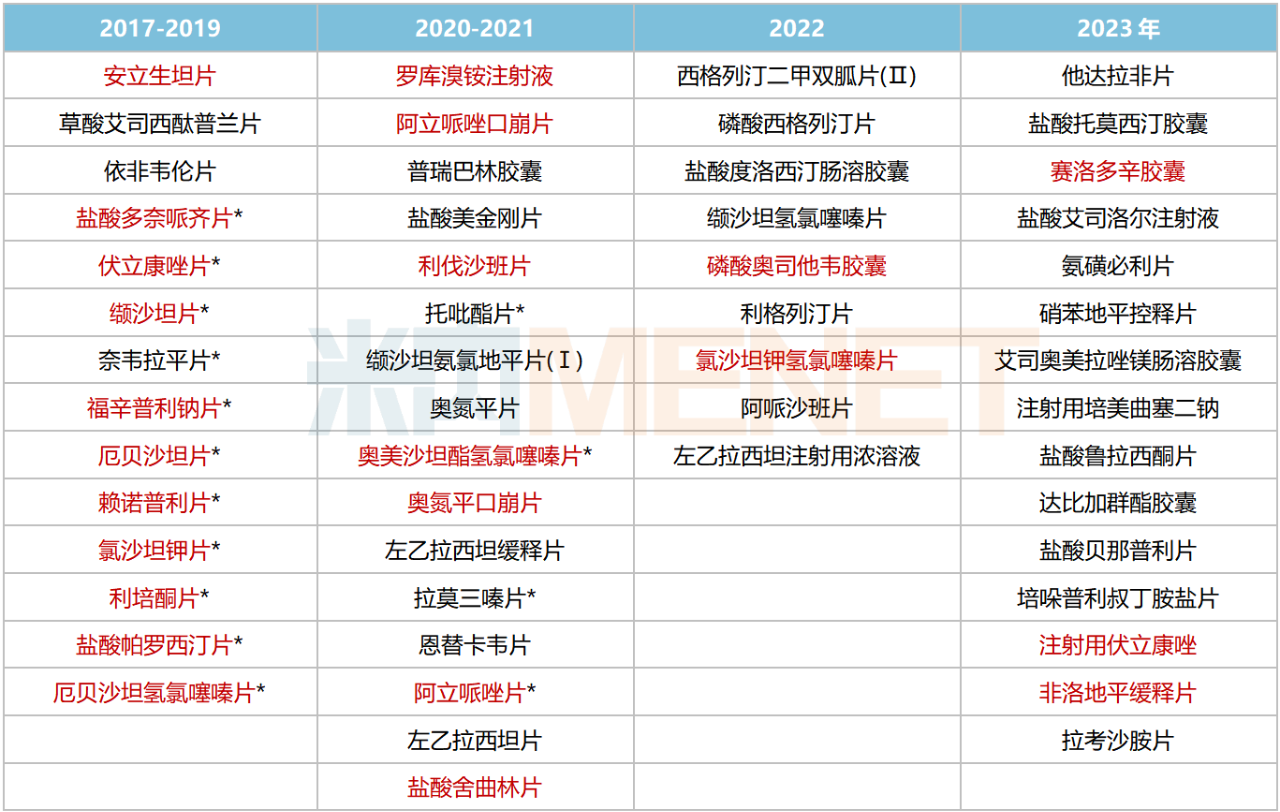
注:带*为首家/独家过评,标红为国采中选
来源:米内网一致性评价进度数据库
在已落地执行的八批九轮化药集采中,华海药业分别有7个、2个、3个、1个、2个、3个、3个、2个品种中标,合计23个品种。集采中标品种快速放量,推动了公司国内制剂业务销售大幅增长,如第三批集采品种奥氮平口崩片,华海药业的产品2023上半年在中国公立医疗机构终端的销售额增速约达450%,市场份额由2020年的0.08%提升至2023上半年的23.21%。
目前华海药业已过评但未纳入集采的品种有9个,其中5个已满足5家及以上的充分竞争条件,其中艾司洛尔注射剂、西格列汀口服常释剂型、利格列汀口服常释剂型2022年在中国公立医疗机构终端的销售额均超过10亿元。
值得一提的是,华海药业2022年在艾司洛尔注射剂、西格列汀口服常释剂型、西格列汀二甲双胍口服常释剂型、利格列汀口服常释剂型4个品种中所占市场份额均为0。
华海药业过评但未集采且已满足5家及以上条件的品种
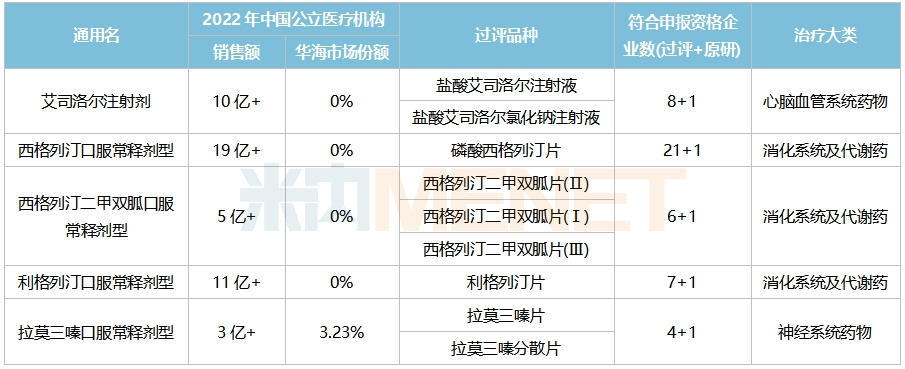
来源:米内网综合数据库
13款1类新药来势汹汹,51个新品冲刺上市
近年来,华海药业持续加快产业转型升级步伐,不断提升研发创新能力,加速生物药和创新药发展。据季报数据,2023前三季度公司研发费用6.67亿元,占营收比重10.75%。
目前华海药业有16款新药在国内处于申请临床及以上阶段,聚焦抗肿瘤、自身免疫、神经系统等治疗领域,其中1类新药有13个。从药物类型看,12个为生物药,4个为化学药。
华海药业国内在研新药
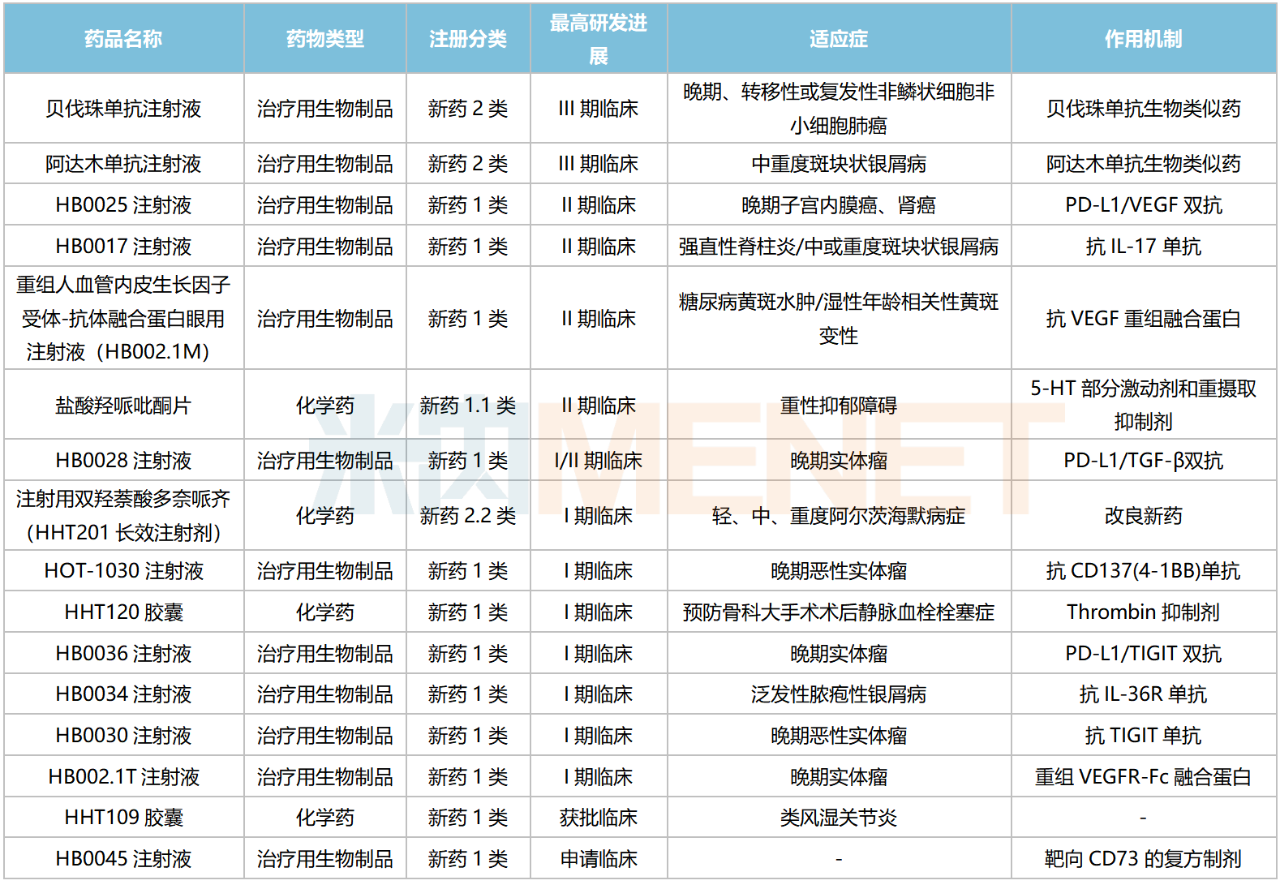
来源:米内网综合数据库
生物药是华海药业重点布局的方向,其中2款生物类似药——阿达木单抗注射液、贝伐珠单抗注射已步入III期临床,上市可期。米内网数据显示,上述两款单抗2022年在中国三大终端六大市场的销售额分别超过20亿元、86亿元。
公司有多款双抗在研,其中HB0025注射液(PD-L1/VEGF双抗)进展最快,其晚期子宫内膜癌、肾癌等适应症已步入II期临床;此外,HB0028注射液(PD-L1/TGF-β双抗)正在开展晚期实体瘤的I/II期临床,HB0036注射液(PD-L1/TIGIT双抗)正在开展晚期实体瘤的I期临床。
仿制药方面,目前华海药业有51个品种以新注册分类申报且在审(以药品名称计,不含已有批文品种),涵盖9个治疗领域,主要集中在神经系统药物(13个)、消化系统及代谢药(13个,12个为糖尿病用药)、心脑血管系统药物(10个,9个为高血压用药)等。
华海药业新分类申报且在审的品种

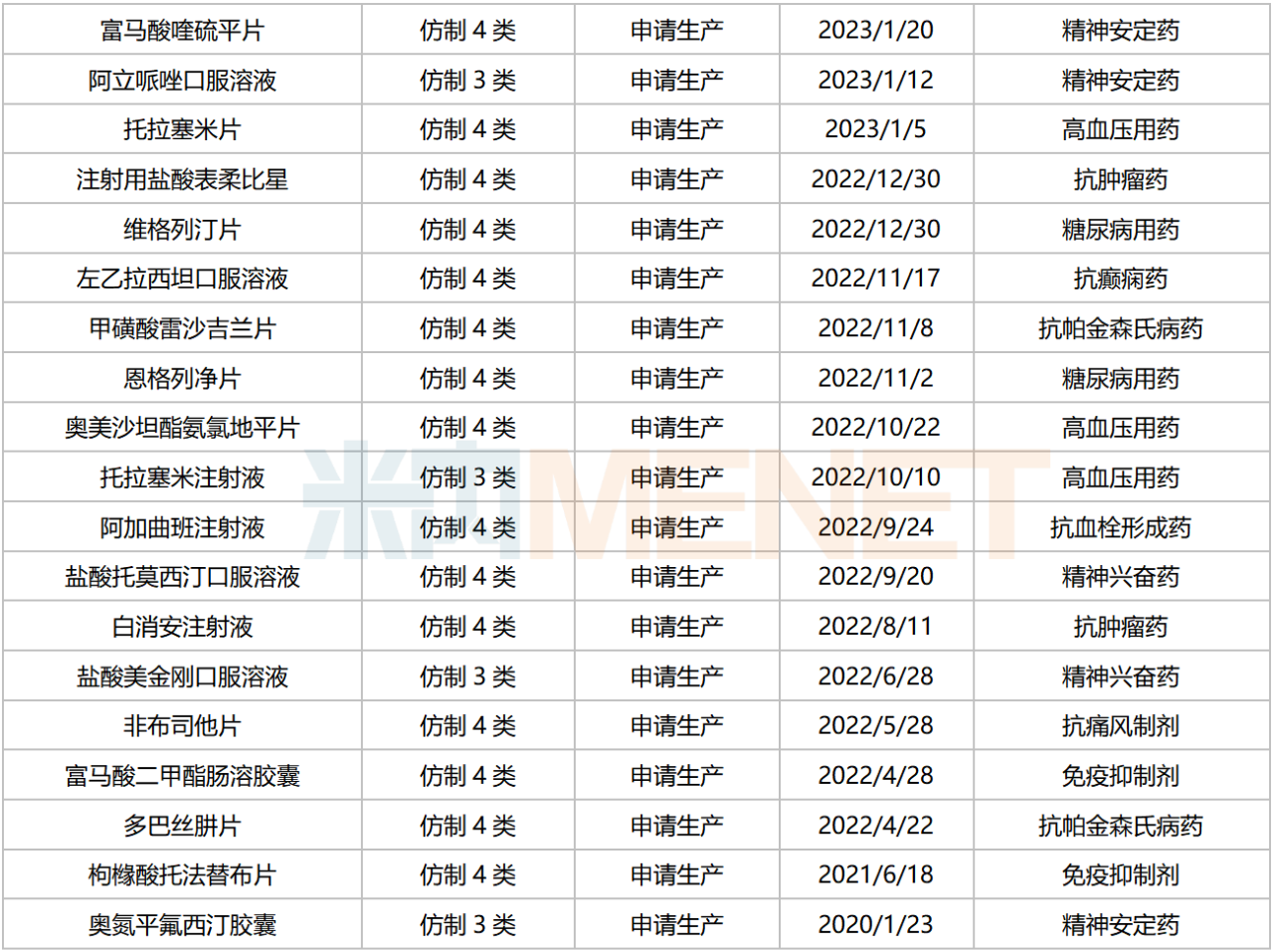
来源:米内网中国申报进度(MED)数据库
坎地沙坦酯氢氯噻嗪片、布瓦西坦片、达格列净二甲双胍缓释片、卡左双多巴缓释片、艾拉戈利钠片等品种暂无首仿(含剂型首仿)获批上市。此外,阿戈美拉汀片、甲氨蝶呤注射液、富马酸二甲酯肠溶胶囊、奥氮平氟西汀胶囊等品种目前仅1家国产企业获批。
9个ANDA文号获批,创新药“出海”持续推进
自成立之初,华海药业就聚焦和深耕海外市场,是国内制药企业拓展国际市场的先导企业。
华海药业是国内首家通过美国FDA制剂认证的企业,深耕美国市场近二十年,华海品牌已被美国主流市场所认可。据半年报数据显示,2023上半年公司美国制剂业务的销售收入同比增长73.3%。
米内网数据显示,2023年华海药业有9个ANDA文号获得FDA批准/暂定批准,涵盖神经系统、心脑血管系统等多个治疗领域。迄今为止,华海药业已有90余个ANDA文号获得FDA批准,其中有多个产品在美国市场占有率名列前茅。
2023年华海药业在美国获批的ANDA
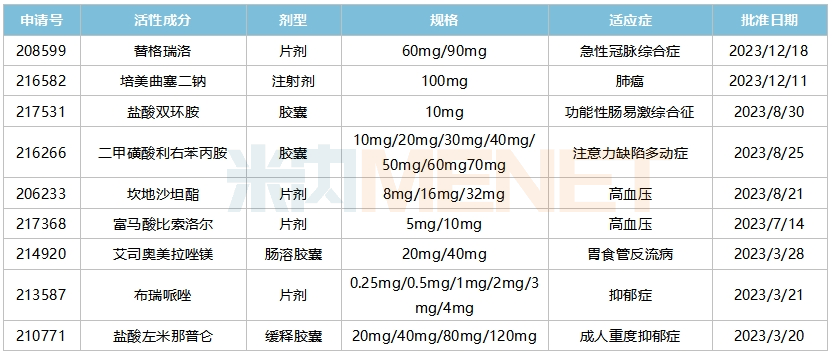
来源:米内网美国FDA数据库
创新药方面,2023年华海药业自主研发的创新药注射用HB0052(CD73 ADC)获得美国FDA批准,可开展晚期实体瘤的临床试验;HB0034注射液(抗IL-36R单抗)获得美国FDA孤儿药认定,用于治疗泛发性脓疱型银屑病(GPP),该新药已在新西兰开展临床试验;HB0025注射液(PD-L1/VEGF双特异性融合蛋白)联合HB0030注射液(抗TIGIT单抗)的Ib/II期临床试验获得FDA批准,适应症为晚期实体瘤。
2023年华海药业发布的创新药在美研发进展的公告

来源:公司公告,米内网整理
据不完全统计,目前华海药业至少有6款新药在美国处于获批临床及以上阶段,包括注射用HB0052(CD73 ADC)、HB0025注射液(PD-L1/VEGF双特异性融合蛋白)、HB0045注射液(靶向CD73的复方制剂)、HB0036注射液(PD-L1/TIGIT双抗)、HB0017注射液(抗IL-17单抗)、HHT201等。
资料来源:米内网数据库、公司公告等
注:米内网《中国三大终端六大市场药品竞争格局》,统计范围是:城市公立医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。数据统计截至1月10日,如有疏漏,欢迎指正!

